ISQUEMIA E REPERFUSÃO POR CIRCULAÇÃO RETRÓGRADA: ESTUDO COMPARATIVO EXPERIMENTAL
Resumo:
Contexto: Membro em isquemia crítica sem leito distal tem opções restritas para tratamento. Desviar o fluxo de maneira retrógrada através da circulação venosa é alternativa amparada em evidências de inúmeros trabalhos publicados. Este conceito baseia-se na teoria de que, na ausência de pressão arterial primária nas arteríolas , o sangue fornecido através do sistema venoso por meio da pressão arterial é capaz de suprir os tecidos periféricos e fornecer oxigenação adequada. Objetivo: Comparar o comportamento de variáveis clínicas e laboratoriais em extremidades de suínos, submetidos à isquemia, a reperfusão por circulação retrógrada e aos padrões fisiológicos. Métodos: Dez suínos foram separados em 2 grupos. No grupo 1 (n=5), avaliaram-se padrões fisiológicos de variáveis como fluxo ao Doppler, temperatura, gasometria, lactato, creatinoquinase e pressão arterial. No grupo 2 (n=5), após um período de isquemia, consequente a interrupção do fluxo nas artérias femorais, os animafis foram submetidos à arterialização venosa, no membro posterior esquerdo e à manutenção da isquemia no direito. As variáveis foram analisadas separadamente durante momentos 0, 2, 3 4 e 6 horas para efeito de comparação entre si e aos padrões fisiológicos. Resultados: A análise das variáveis mostrou em ambos os procedimentos queda de BE e pO2 com elevação de lactato e creatinoquinase. Nos membros arterializados encontramos fluxo ao Doppler, maiores pressões arteriais e temperaturas. Conclusões: A análise comparativa das extremidades em isquemia e arterializada mostrou, em relação aos padrões fisiológicos, um quadro de acidose metabólica com significativo dano celular e sinais de reperfusão retrógrada nas extremidades arterializadas.
Palavras-chave: Arterialização venosa, isquemia, reperfusão.
Abstract
Background: The limb in critical ischemia without distal patency has restricted options for treatment. Diverting flow through the venous circulation is an alternative supported by numerous published works evidence. This concept is based on the theory that, in the absence of primary arterial pressure in the arterioles, the blood supplied through the venous system through blood pressure is able to supply the peripheral tissues and provide adequate oxygenation. Objective: Compare the behavior of clinical and laboratory variables in hind limbs of pigs, submitted to ischemia and reperfusion by retrograde circulation in relation to physiological patterns. Methods: Ten pigs were divided into 2 groups. In group 1 (n=5), we evaluated physiological patterns of variables such as flow through the Doppler, temperature, blood gases, lactate, creatine kinase and blood pressure. In group 2 (n=5) after a period of ischemia, resulting interruption of the flow in the femoral arteries, the animals underwent venous arterialization in the left hind limb and the right limb was kept in ischemia. The variables were analyzed separately for at 0, 2, 3, 4 and 6 hours for comparison between itself and physiological patterns. Results: The analysis of the variables showed, in the two procedures, a decrease in BE and PO2 with increased lactate and creatine kinase. In limbs submitted to arterialization, we found flow Doppler maintenance, higher blood pressures and temperatures. Conclusions: Our findings are consistent with metabolic acidosis with significant cell damage at both limbs, and signs of retrograde reperfusion in arterialized limb. Keywords: venous arterialization, ischemia, reperfusion.
Introdução
Em isquemia crítica sem leito arterial distal não é possível derivar o sangue para uma extremidade arterial pérvia distal à obstrução. Desviar o fluxo de maneira retrógrada através da circulação venosa é uma alternativa viável amparada em evidências de inúmeros trabalhos publicados1-13. Este conceito baseia-se na teoria de que, na ausência de pressão arterial primária nas arteríolas , o sangue fornecido utilizando o sistema venoso distal por meio da arterialização é capaz de suprir os tecidos periféricos e fornecer oxigenação adequada3,4,5,13.
A arterialização venosa do pé é possível , eficaz e de longa duração, provavelmente graças à indução de uma neo – arteriogênese e neo – angiogênese que mantêm os benefícios mesmo após a oclusão da fístula (função temporal)6.
Diversas variáveis têm sido utilizadas para a avaliação de hipóxia tecidual em modelos animais, como avaliação do fluxo arterial através de aparelho Doppler14,15, aferição da temperatura16 gasometria17, dosagem de lactato18, creatinoquinase (CK)19 e medidas de pressão arterial de extremidade20. O objetivo deste trabalho é comparar o comportamento destas variáveis clínicas e laboratoriais em extremidades de suínos, submetidas à isquemia, à reperfusão por circulação retrógrada e aos padrões fisiológicos.
Métodos
Este projeto foi aprovado pelo Comitê de Ética em Pesquisa Animal (CEUA 009/2013) e realizado no Laboratório de Técnica Operatória e Cirurgia Experimental da Universidade Estadual de Ponta Grossa. Foram utilizados 10 suínos cruzados Large White-Landrace, divididos em 2 grupos. Grupo 1 (n=5) – para avaliação dos padrões fisiológicos de qualidade de fluxo arterial pelo aparelho Doppler, temperatura, gasometria arterial (pH, excesso de base, bicarbonato, pressão parcial de oxigênio e pressão parcial de dióxido de carbono), lactato, creatinoquinase (CK) e pressão arterial em extremidades posteriores. As determinações foram realizadas em animais destinados à aula prática de Técnica Operatória antes dos procedimentos cirúrgicos. Grupo 2 (n=5) – Determinação das variáveis pesquisadas no grupo 1 em reperfusão por arterialização venosa do membro posterior esquerdo e em isquemia do direito.
Os animais receberam medicação pré-anestésica com ketamina (14mg/kg), xilazina (02mg/kg) e acepromazina (0,4mg/kg). Foram induzidos com propofol (5mg/kg) e mantidos em anestesia inalatória com isofluorano em concentração alveolar mínima de 1,2 a 1,7%.
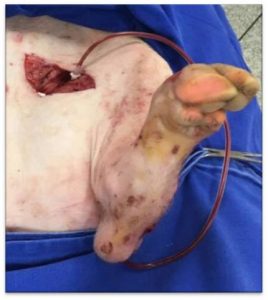
A arterialização venosa foi realizada nos membros posteriores esquerdos dos suínos do grupo 2 utilizando a veia safena externa (parva), que foi dissecada previamente. Após anticoagulação sistêmica com 5000 UI de heparina, realizou-se ligadura proximal, venotomia e rotura das válvulas a jusante com auxílio do valvulótomo de Lengua. Dilatação distal com soro heparinizado através de sonda nº4. Canalização e fixação com cateter intravascular nº 14 (Cateter intravenoso ESCALPE sem ponta de entrada, com parede de Teflon Esterilizado por Óxido de Etileno; SOLIDOR®). Dissecção de veia femoral para coleta de amostras de sangue venoso. A artéria femoral comum foi dissecada e, após arteriotomia, suas extremidades distais e proximais foram canalizadas com cateter intravascular nº14 e ligadas.
Iniciou-se a medida do tempo de isquemia com a arteriotomia. Procedeu-se a conexão das extremidades proximais das artérias femorais comum com as veias safenas nos membros arterializados, com a utilização de um cateter de silicone, (EXTENSOR para Cateter Reversível Luer Lock 20cm, 2 conectores macho – 10F; HARTMANN®) iniciando-se a contagem do tempo de arterialização (Figura 1). Nos membros posteriores direito, dos grupos 1 e 2, procedeu-se apenas a dissecção dos vasos femorais utilizando-se a técnica descrita. Nos animais do grupo 1 apenas para determinação basal das variáveis estudadas e no grupo 2 a oclusão dos cateteres arteriais levou as extremidades à isquemia.
Após o término dos procedimentos cirúrgicos e durante tempos 0, 2, 4 e 6 horas, respectivamente momentos T0, T1, T2 e T3, ao longo da investigação, realizou-se pesquisa da presença de fluxo sanguíneo nas extremidades com auxílio de um aparelho Doppler portátil (Doppler Vascular DV 600; Martec®) e aferição da temperatura com termômetro infravermelho (Termômetro Infravermelho Sem Contato FR1DZ1; G-TECH®). O fluxo sanguíneo foi avaliado na artéria safena, em cada membro. As aferições de temperatura foram realizadas, em 3 tempos, em um ponto fixo no espaço interdigital na região plantar e, na região dorsal, em 3 pontos distantes um do outro cerca de 3 cm ao longo da extremidade de cada membro. A distância entre o termômetro e a pele foi de, aproximadamente, 3 a 5 cm.
Nos tempos 0, 3 e 6 horas, respectivamente momentos T0, T1 e T2, durante a investigação, colheram-se, com seringas heparinizadas de 3 ml, amostras de sangue arterial para gasometria, através das extremidades distais das arteriotomias (femoral superficial); por punção direta das femorais, sangue venoso para dosagem de lactato e CK; e utilizando-se régua e equipo em coluna de soro fisiológico, determinaram-se as pressões nas extremidades arteriais distais (femoral superficial) e proximais (femoral comum).
Procedeu-se a administração de 5000 UI de heparina a cada 3 horas durante o transcorrer da pesquisa.
Ao final dos procedimentos, os animais do grupo 2 foram submetidos à eutanásia conforme resolução 1000/2012 do Conselho Federal de Medicina Veterinária (CFMV).
Análise estatística
Os resultados foram submetidos à análise quanto à distribuição de normalidade de acordo com o Teste de Anderson Darling. O Teste qui-quadrado com correção de Yates foi utilizado para variáveis qualitativas, e o Teste t de Student utilizado para variáveis quantitativas, sendo estatisticamente significativo p < 0,05.
Resultados
As variáveis pesquisadas em membros posteriores reperfundidos por arterialização, com tempo médio de isquemia de 27 minutos e trinta segundos, foram comparadas, nos mesmos animais, às determinadas em igual número de membros posteriores submetidos à isquemia, grupo 2, e aos padrões fisiológicos encontrados no grupo 1.
Fluxo arterial
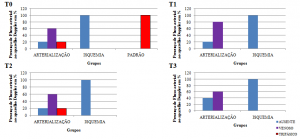
A pesquisa de fluxo arterial ao Doppler nos membros arterializados mostrou em T0: ausência em um, padrão venoso pulsátil em três e pulsátil arterial em um; em T1 o membro pulsátil arterial passou a apresentar padrão venoso pulsátil; em T2 o mesmo membro voltou a apresentar padrão pulsátil arterial e em T3 três membros apresentavam padrão pulsátil venoso e dois, ausência de fluxo. Os membros submetidos à isquemia apresentaram ausência de fluxo ao longo da pesquisa. (Figura 2).
Foram considerados para determinação das médias das variáveis estudadas apenas os valores encontrados nos membros arterializados e em isquemia, cujos animais apresentavam fluxo ao Doppler no momento da coleta de amostra ou da determinação de dados.
Temperatura
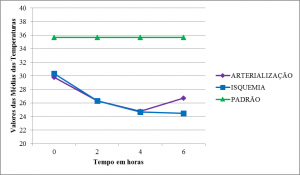
Embora não tenha havido controle ambiental, as médias de variação da temperatura, nas extremidades estudadas, apresentaram curvas semelhantes com médias significativamente inferiores à determinada como padrão ao longo do tempo (Tabela 1). (Figura 3).
| Tabela 1. COMPARAÇÃO DA TEMPERATURA DE MEMBROS ARTERIALIZADOS E EM ISQUEMIA EM RELAÇÃO AO GRUPO PADRÃO NOS DIFERENTES MOMENTOS. | |||||||||||||
| Arterialização | Padrão | p | Isquemia | Padrão | p | ||||||||
| Temperatura (momentos) | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | |||||||||
| T0 | 29,81 (3,77) | 35,65 (0,55) | 0,01 | 30,37 (3,97) | 35,65 (0,55) | 0,02 | |||||||
| T1 | 26,34 (4,46) | 35,65 (0,55) | 0,002 | 26,32 (3,45) | 35,65 (0,55) | 0,0005 | |||||||
| T2 | 24,77 (2,62) | 35,65 (0,55) | 0,0001 | 24,70 (2,35) | 35,65 (0,55) | 0,0001 | |||||||
| T3 | 26,74 (5,67) | 35,65 (0,55) | 0,010 | 24,49 (2,20) | 35,65 (0,55) | 0,0001 | |||||||
| Teste t de Student | |||||||||||||
Gasometria
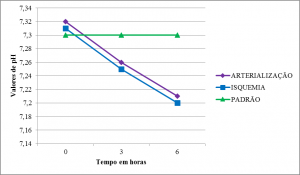
O pH dos membros arterializados e em isquemia partiu de níveis levemente superiores ao padrão, e apresentaram curvas semelhantes com queda em T1 um pouco mais acentuada do que em T2 (Tabelas 2,3 e 4) (Figura 4).
Excesso de base
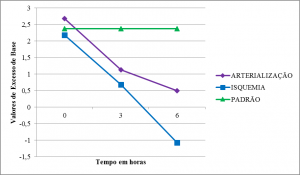
Tanto os membros arterializados quanto aqueles em isquemia apresentaram uma queda progressiva do excesso de base (BE), mais acentuada nos em isquemia (Tabelas 2,3 e 4) (Figura 5).
Concentração de bicarbonato
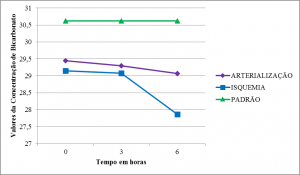
Tanto os membros arterializados quanto aqueles em isquemia apresentaram uma queda progressiva da concentração de bicarbonato (HCO3–), mais acentuada em isquemia, especialmente no momento T2 (Tabelas 2,3 e 4) (Figura 6).
Pressão parcial de oxigênio
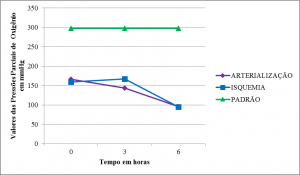
As Pressões parciais de oxigênio (pO2) nos membros arterializados e em isquemia partiram de níveis menores que o padrão e apresentaram curvas semelhantes com queda significativa em T2 (Tabelas 2,3 e 4) (Figura 7).
Pressão parcial de dióxido de carbono
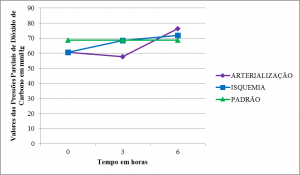
As pressões parciais de dióxido de carbono (pCO2) mostraram valores semelhantes e inferiores ao padrão no momento T0 com aumento progressivo da média em isquemia e leve queda na média arterialização em T1. A isquemia se manteve estável enquanto houve aumento progressivo na arterialização em T2 (Tabelas 2,3 e 4) (Figura 8).
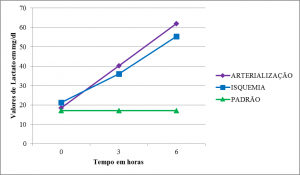
Lactato
As médias dos valores de lactato partiram de nível próximo ao padrão e apresentaram curvas semelhantes com aumento progressivo em T1, significativo para arterialização, e mais acentuado e significativo para arterialização e para isquemia no momento T2 (Tabelas 2,3 e 4) (Figura 9).
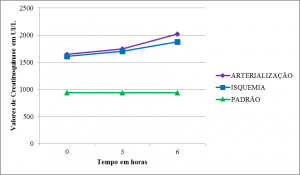
Creatinoquinase
As médias dos valores de CK partiram de níveis superiores ao padrão mostrando aumento significativo para arterialização e para isquemia em T1 e T2 (Tabelas 2,3 e 4) (Figura 10).
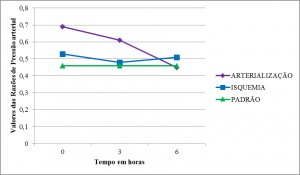
Pressão arterial
Para efeito de cálculo foram consideradas as razões de pressões arteriais distais pelas proximais. Nos membros arterializados partiram de nível superior ao padrão e acima dos membros em isquemia. Apresentaram queda em T1, embora, os arterializados tenham permanecido em nível mais elevado. Em T2, as curvas se aproximaram do padrão (Figura 11).
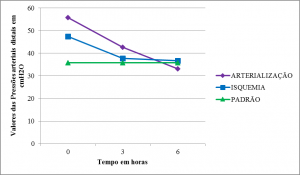
As curvas de valor absoluto das pressões distais apresentaram padrão semelhante às razões (Tabelas 2,3 e 4) (Figura 12).
| Tabela 2. COMPARAÇÃO DAS VARIÁVEIS BIOQUÍMICAS E DE PRESSÃO ARTERIAL EM MEMBROS ARTERIALIZADOS E EM ISQUEMIA EM RELAÇÃO AO GRUPO PADRÃO NO MOMENTO T0. | |||||||||||||
| Arterialização | Padrão | p | Isquemia | Padrão | p | ||||||||
| Variáveis | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | |||||||||
| pH | 7,32 (0,11) | 7,30 (0,15) | 0,83 | 7,31 (0,12) | 7,30 (0,15) | 0,92 | |||||||
| BE | 2,68 (1,02) | 2,38 (2,47) | 0,83 | 2,18 (1,38) | 2,38 (2,47) | 0,89 | |||||||
| HCO3– | 29,45 (1,77) | 30,62 (4,17) | 0,62 | 29,15 (2,29) | 30,62 (4,17) | 0,55 | |||||||
| pO2 | 166,33 (61,91) | 298,10 (128,32) | 0,10 | 158,93 (58,34) | 298,10 (128,32) | 0,09 | |||||||
| pCO2 | 60,75 (16,19) | 68,82 (34,49) | 0,68 | 60,60 (17,63) | 68,82 (34,49) | 0,68 | |||||||
| Lactato | 18,55 (2,99) | 17,14 (6,96) | 0,72 | 21,20 (10,28) | 17,14 (6,96) | 0,50 | |||||||
| CK | 1647,50 (590,89) | 940,00 (364,18) | 0,06 | 1612,50 (563,68) | 940,00 (364,18) | 0,07 | |||||||
| Pressão arterial | 55,75 (15,76) | 35,86 (22,86) | 0,18 | 47,50 (22,49) | 35,86 (22,86) | 0,47 | |||||||
| Teste t de Student | |||||||||||||
| Tabela 3. COMPARAÇÃO DAS VARIÁVEIS BIOQUÍMICAS E DE PRESSÃO ARTERIAL EM MEMBROS ARTERIALIZADOS E EM ISQUEMIA EM RELAÇÃO AO GRUPO PADRÃO NO MOMENTO T1. | |||||||||||||
| Arterialização | Padrão | p | Isquemia | Padrão | p | ||||||||
| Variáveis | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | |||||||||
| pH | 7,26 (0,08) | 7,30 (0,15) | 0,65 | 7,25 (0,06) | 7,30 (0,15) | 0,55 | |||||||
| BE | 1,13 (1,97) | 2,38 (2,47) | 0,44 | 0,68 (1,41) | 2,38 (2,47) | 0,26 | |||||||
| HCO3– | 29,30 (1,47) | 30,62 (4,17) | 0,57 | 29,08 (1,28) | 30,62 (4,17) | 0,50 | |||||||
| pO2 | 143,65 (89,98) | 298,10 (128,32) | 0,08 | 167,53 (143,26) | 298,10 (128,32) | 0,19 | |||||||
| pCO2 | 57,80 (23,85) | 68,82 (34,49) | 0,61 | 68,40 (11,02) | 68,82 (34,49) | 0,98 | |||||||
| Lactato | 40,30 (19,38) | 17,14 (6,96) | 0,04 | 36,10 (21,17) | 17,14 (6,96) | 0,10 | |||||||
| CK | 1747,00 (556,34) | 940,00 (364,18) | 0,03 | 1704,25 (554,79) | 940,00 (364,18) | 0,04 | |||||||
| Pressão arterial | 42,63 (19,61) | 35,86 (22,86) | 0,65 | 37,75 (15,76) | 35,86 (22,86) | 0,89 | |||||||
| Teste t de Student | |||||||||||||
| Tabela 4. COMPARAÇÃO DAS VARIÁVEIS BIOQUÍMICAS E DE PRESSÃO ARTERIAL EM MEMBROS ARTERIALIZADOS E EM ISQUEMIA EM RELAÇÃO AO GRUPO PADRÃO NO MOMENTO T2. | |||||||||||||
| Arterialização | Padrão | p | Isquemia | Padrão | P | ||||||||
| Variáveis | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | Média (Desvio Padrão) | |||||||||
| pH | 7,21 (0,12) | 7,30 (0,15) | 0,41 | 7,20 (0,09) | 7,30 (0,15) | 0,34 | |||||||
| BE | 0,50 (3,58) | 2,38 (2,47) | 0,41 | 1,07 (2,72) | 2,38 (2,47) | 0,11 | |||||||
| HCO3– | 29,07 (1,61) | 30,62 (4,17) | 0,57 | 27,87 (2,48) | 30,62 (4,17) | 0,35 | |||||||
| pO2 | 95,83 (13,82) | 298,10 (128,32) | 0,04 | 94,67 (3,89) | 298,10 (128,32) | 0,04 | |||||||
| pCO2 | 76,23 (21,75) | 68,82 (34,49) | 0,75 | 71,87 (15,09) | 68,82 (34,49) | 0,89 | |||||||
| Lactato | 61,93 (19,70) | 17,14 (6,96) | 0,003 | 55,33 (19,15) | 17,14 (6,96) | 0,006 | |||||||
| CK | 2020,67 (621,81) | 940,00 (364,18) | 0,02 | 1879,33 (425,96) | 940,00 (364,18) | 0,02 | |||||||
| Pressão arterial | 33,17 (19,20) | 35,86 (22,86) | 0,87 | 36,67 (13,58) | 35,86 (22,86) | 0,96 | |||||||
| Teste t de Student | |||||||||||||
Discussão
Não existem trabalhos experimentais de isquemia e reperfusão (I/R) por arterialização, em animais, que tenham testado as variáveis estudadas. Nosso modelo produz uma isquemia aguda diferente da crônica em que o tempo em isquemia sem necrose pode levar à produção de estímulos para arteriogênese.
Embora os procedimentos tenham sido realizados no mesmo animal, em ambos os membros posteriores, as variáveis estudadas foram determinadas separadamente. A utilização do membro contralateral é frequente em estudos de isquemia unilateral 21,22, pois permite que as medidas sejam realizadas sobre o mesmo substrato, embora não se possa afastar totalmente a interferência de um membro sobre o contralateral.
Foram desprezados os valores determinados, tanto no membro arterializado quanto no em isquemia, quando não havia fluxo ao Doppler na extremidade arterializada.
A presença de fluxo ao Doppler mostrou padrão pulsátil arterial e venoso pulsátil, este também encontrado em fístulas arteriovenosas23.
Sasajima et al., em estudo de arterialização venosa profunda em camundongos, mostrou que a rotura das válvulas ao nível de veia femoral eram acompanhadas de aumento de temperatura cutânea em região coxofemoral e articulação do joelho. Mostrou ainda que a hipertermia em extremidade distal só ocorria quando as válvulas de veia poplítea eram rompidas10.
O aumento da temperatura do membro arterializado, observado a partir do momento T2, sugere perviedade do sistema e corrobora a utilidade da valvulotomia na veia arterializada.
Durante a reperfusão, o edema tecidual acaba se instalando com potencial agravante da injúria tecidual e da resposta sistêmica. No contexto da I/R, alterações locais e sistêmicas se desenvolvem em diversos sistemas: endotelial, sanguíneo, metabólico, ácido-base, etc20.
Szokoly et al. demonstraram em ratos, submetidos a isquemia-reperfusão de membros posteriores, uma queda continua e significativa do pH venoso comparado ao basal na primeira hora. Esta mudança foi acompanhada de alterações na pCO2 e pO2 que apresentaram sinais moderados de compensação respiratória20.
Mondek et al. mostrou um estudo piloto em que o grau máximo de acidose ocorreu duas horas após o início da reperfusão em membro isquêmico devido a clampeamento vascular . A amostra de sangue foi colhida na veia femoral ipsolateral24.
Nossos achados mostram um quadro de acidose metabólica com queda no valor de BE e pouca alteração em HCO3–. A queda de BE sugere tamponamento que permite certa estabilidade nos valores do pH. As variações na pCO2 e pO2 foram inespecíficas apresentando queda significativa da pO2 acompanhada de aumento da pCO2 ao final do experimento. Estes achados são compatíveis com outros estudos sobre I/R 20 25.
Os trabalhos de Szokoly e Mondek avaliaram o pH na veia coletora do membro, visto que a reperfusão se deu por via arterial20 24. Em nossa pesquisa, determinamos a gasometria na extremidade distal da artéria femoral uma vez que a reperfusão se deu por via venosa, e nossa intenção era avaliar o fluxo retrógrado.
Sako et al., durante cirurgia de aneurisma de aorta abdominal que envolve I/R de extremidades, evidenciou aumento transitório de lactato e redução de pH em veias ilíacas pós-reperfusão26.
Theodoraki et al., em estudo sobre grandiente transhepático de lactato durante I/R em hepatectomias, encontrou aumento na produção de lactato hepático observado 50 minutos após a reperfusão. Mostrou ainda correlação positiva entre os níveis de lactato intraoperatório sistêmico e o gradiente trans-hepático de lactato, sugerindo uma significativa contribuição da reperfusão hepática ao estado de hiperlactatemia sistêmica27.
Nossas médias de valores de lactato partiram de nível semelhante ao padrão e apresentaram curvas semelhantes com aumento progressivo significativamente mais acentuado na arterialização onde ocorreu reperfusão por via retrógrada.
Woodruff et al., em estudo para avaliar a capacidade de um fármaco contra a injúria provocada pela isquemia e subsequente reperfusão (I/R), demonstraram a elevação de CK no grupo submetido a I/R, o que não foi observado no grupo submetido somente à isquemia28. Isto pode sugerir que a base patogênica para a elevação do marcador de injúria muscular seria a reperfusão após isquemia.
Nossos valores de CK apresentaram comportamento semelhante ao lactato mostrando aumentos significativos em T1, e ainda mais acentuados em T2, especialmente no membro em reperfusão.
Szokoly et al., ao estudar I/R em membros posteriores de camundongos, encontrou queda da pressão arterial média em torno de 20% após a reperfusão. Possíveis eventos compensatórios paralelos ao procedimento ou, até mesmo, à vasodilatação devido à reperfusão do membro podem explicar a queda dos valores de pressão20.
A média das razões de pressões arteriais dos membros arterializados partiu de nível superior ao padrão e acima dos membros em isquemia. Apresentaram queda em T1, embora, os arterializados tenham permanecido em nível mais elevado. Em T2, as curvas se aproximaram do padrão. A queda da pressão arterial distal foi semelhante à curva das razões entre a pressão arterial distal e proximal, o que não sugere a interferência da pressão arterial proximal nos valores encontrados.
Conclusão
Nossos achados são compatíveis com quadros de acidose metabólica, com significativo dano celular em ambas as extremidades, e sinais de reperfusão retrógrada nos membros arterializados.
Referências
- Alexandrescu V, Ngongang C, Vincent G, Ledent G, Hubermont G. Deep calf veins arterialization for inferior limb preservation in diabetic patients with extended ischaemic wounds, unfit for direct arterial reconstruction: preliminary results according to an angiosome model of perfusion. Cardiovasc Revasc Med. 2011;12(1):10-9.
- Djoric P. Early individual experience with distal venous arterialization as a lower limb salvage procedure. Am Surg. 2011;77(6):726-30.
- Busato CR, Utrabo CAL, Gomes RZ, Hoeldtke E, Housome JK, Costa DMM, Busato CD. Utilização da safena magna in situ para arterialização do arco venoso do pé. J Vasc Bras, 2010;9:119-123.
- Taylor RS, Belli AM, Jacob S. Distal venous arterialization for salvage of critically ischaemic inoperable limbs. Lancet. 1999;354:1962-65.
- Mutirangura P, Ruangsetakit C, Wongwanit C, Sermsathanasawadi N, Chinsakchai K. Pedal bypass with deep venous arterialization: the therapeutic option in critical limb ischemia and unreconstructable distal arteries. Vascular. 2011;19:313-319.
- Lengua F, La Madrid A, Acosta C; Vargas J. Arterializacion venosa temporal del pie diabético. J Vasc Bras. 2010;9:14-20.
- Lu XW, Idu MM, Ubbink DT, Legemate DA. Meta-analysis of the clinical effectiveness of venous arterialization for salvage of critically ischaemic limbs. Eur J Vasc Endovasc Surg. 2006;31(5):493-9.
- Özbek C, Kestelli M, Emrecan B, et al. A novel approach: ascending venous arterialization for atherosclerosis obliterans. Eur J Vasc Endovasc Surg. 2005;29(1):47-51.
- Schreve MA, Minnee RC, Bosma J, Leijdekkers VJ, Idu MM, Vahl AC. Comparative study of venous arterialization and pedal bypass in a patient cohort with critical limb ischemia. Ann Vasc Surg. 2014;28(5):1123-7.
- Sasajima T, Kikuchi S, Ishikawa N, Koyama T. Skin temperature in lower hind limb subjected to distal vein arterialization in rats. Adv Exp Med Biol. 2014;812:361-8.
- Houlind K, Christensen J, Hallenberg C, Jepsen JM. Early results from an angiosome-directed open surgical technique for venous arterialization in patients with critical lower limb ischemia. Diabetic Foot & Ankle 2013; 4:22713.
- Ozbek C, Kestelli M, Bozok S, Ilhan G, Yurekli I, Ozpak B, Akyuz M, Bademci M. Surgical stimulation of angiogenesis. Asian Cardiovasc Thorac Ann. 2012;22:36-9.
- Busato CR, Utrabo CAL, Lipinski LC, Montemór Netto MR, Tolentino ES, Busato FAO, Guilherme Filho MD. Experimental model for the study of retrograde flow. J Vasc Bras. 2016; 15 (2):93-98.
- Bordinhão A. Comparação entre a Dopplermetria e o fluxo livre da artéria torácica interna de cães com e sem o uso de noradrenalina. Rev Bras Cir Cardiovasc. 2013;28:224-30.
- Poerschke RA, Silveira DA, Lodi P, Titton W, Marx G, Lampert AS. Temporary vascularization on ischemic limbs through arterial-medular shunt: an experimental work. J Vasc Bras. 2012;11:29-33.
- Brioschi ML, Mehl A, De Oliveira AGN, Freitas MAS, Macedo JF, Matias JEF, Macedo RAC. Exame de termometria cutânea infravermelha na avaliação do pé diabético. Rev Méd Paraná. 2007;65:33-41.
- Rojas PH, Tannous LA, Bahten LCV, Villegas FC, Gasparetto J. Análise da gasometria e dos niveis de lactato na hipertensão intra-abdominal associada à sepse abdominal: Modelo experimental em ratos. Panamerican J Trauma. 2013;2:49-51.
- Nagy O, Seidel H, Paulíková I, Mudron P, Kovác G. Use of blood gases and lactic acid analyses in diagnosis and prognosis of respiratory diseases in calves. Bull Vet Inst Pulawi. 2006;50:149-152.
- Currie IS, Wakelin SJ, Lee AJ, Chalmers RT. Plasma creatine kinase indicates major amputation or limb preservation in acute lower limb ischemia. J Vasc Surg. 2006;45:733-739.
- Szokoly M, Nemeth N, Hamar J, Furka I, Miko I. Early systemic effects of hind limb ischemia-reperfusion on hemodynamics and acid-base balance in the rat. Microsurgery. 2006;4:585-589.
- Thaveau F, Zoll J, Bouitbir J, Ribera F, Di Marco P, Chakfe N, Kretz JG, Piquard F, Geny B. Contralateral leg as a control during skeletal muscle ischemia-reperfusion. J Surg Res. 2009;155:65-9.
- Mansour Z, Bouitbir J, Charles AL, Talha S, Kindo M, Pottecher J, Zoll J, GENY B. Remote and local ischemic preconditioning equivalently protects rat skeletal muscle mitochondrial function during experimental aortic cross-clamping. J. Vasc. Surg, 2012;55:497-505.
- Barros FS, Pontes SM, De Paula e Silva W, Prezotti BB, Sandri JL. Identificação pelo Doppler colorido de fístula arteriovenosa na trombose venosa profunda. J Vasc Bras. 2006;5:224-8.
- Mondek P, Sefranek V, Tomka J, Pechan I, Silvanova E, Nasal R, Slysko R. Regional biochemical and hematologic changes in patients after revascularization of the lower extremities in ischemia of the extremities. Rozhl Chir. 2002;21:995–1001.
- Tejchman K, Domanski L, Sienko J, Sulikowski T, Kaminski M, Romanwski M, Pabisiak K, Ostrowski M, Ciechanowski K. Early Acid-Base Balance Disorders During Kidney Transplantation. Trans Proceed. 2006; 38:123-126.
- Sako H, Hadama T, Miyamoto S, Anai H, Wada T, Iwata E, Hamamoto H, Tanaka H, Morita M. Limb Ischemia and Reperfusion During Abdominal Aortic Aneurysm Surgery. Surg Today. 2004;34:832-836.
- Theodoraki K, Arkadopoulos N, Fragulidis G, Voros D, Karapanos K, Markatou M, Kostopanagiotou G, Smyrniotis V. Transhepatic Lactate Gradient in Relation to Liver Ischemia/Reperfusion Injury During Major Hepatectomies. Liver Transplantation. 2006;12:1825-1831.
- Woodruff TM, Arumugam TV, Shiels ia, Reid RC, Fairlie DP, Taylor SM. Protective effects of potent C5a receptor antagonist on experimental acute limb ischemia-reperfusion in rats. J Surg Res. 2004;116:81-90.